Les avantages à ajouter un outil dans une infrastructure mutualisée
- Sécurité : L’installation du nouvel outil implique son intégration harmonieuse au sein des briques applicatives existantes, tout en respectant les exigences réglementaires et en garantissant la mise en place de flux sécurisés avec l'entrepôt de données de France Cohortes.
- Simplification des démarches réglementaires : Le document d’analyse d’impact sur la protection des données (AIPD) a en conséquence été enrichi et transmis aux cohortes, facilitant ainsi les démarches réglementaires.
- Accompagnement : Des formations ont été prévues pour les cohortes pour faciliter la prise en main de l'outil, et ainsi, le démarrage et la réalisation de leurs projets.
- Accès à un bouquet d’outils intégrés : La mutualisation d’outils simplifie la contractualisation et facilite l’ouverture d’environnements dédiés au traitement de données pour les cohortes.
Un outil de collecte de données adapté aux spécificités cliniques
Disposer d’un outil de collecte de données clinique était essentiel pour les cohortes cliniques du programme RaDiCo, telles qu’ECYSCO ou PID/ILD2, afin de poursuivre leurs campagnes auprès de participants atteints de maladies rares.
C'est pourquoi Simon-Pierre Durieux, ingénieur spécialisé en solutions de collecte de données chez France Cohortes, a conduit une analyse approfondie pour identifier l’outil le mieux adapté.
Contrairement aux cohortes en population générale, où les participants remplissent eux-mêmes les questionnaires, les cohortes cliniques impliquent une collecte par des professionnels de santé au sein des établissements hospitaliers.
L’outil devait donc répondre à des besoins spécifiques : gestion fine des droits d’accès pour différents profils (attachés de recherche, techniciens, investigateurs) ; cloisonnement des données entre les centres ; intégration de thésaurus médicaux structurés tels que la CIM-10 ou MedDRA.
Il devait également permettre la gestion de données complexes (imagerie, vidéos, rapports médicaux) et inclure des fonctionnalités pour le monitoring des études.
Le respect des standards internationaux, comme le CDISC, s’est imposé pour garantir l’accessibilité et l’interopérabilité des données, des critères essentiels pour leur réutilisation à long terme.
La conformité réglementaire
Sur le plan réglementaire, l’outil sélectionné devait se conformer aux référentiels de la CNIL, la Commission Nationale Informatique et Libertés, et aux recommandations de l’ANSSI, l’Agence nationale de la sécurité des systèmes d’information.
Le cadre méthodologique des entrepôts de données de santé (EDS) a été utilisé comme base pour définir les exigences : chiffrement des données identifiantes, séparation stricte des données cliniques et des données de contact, et mise en place d’une authentification renforcée.
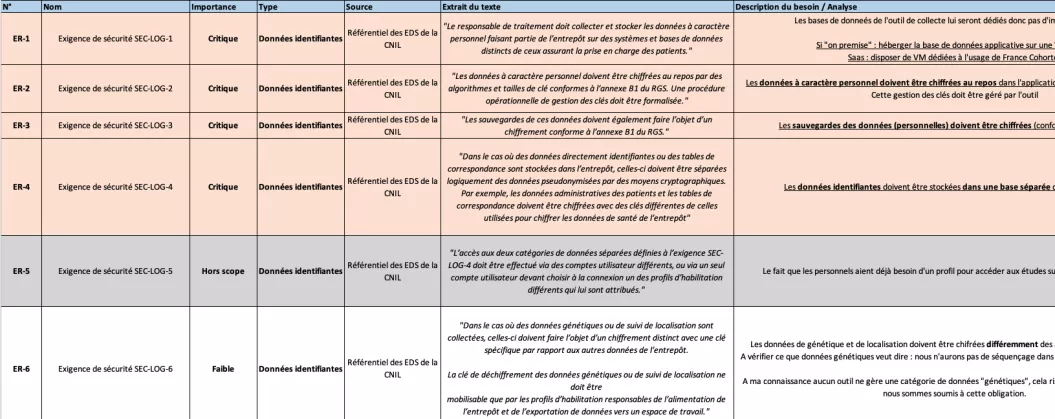
Un aperçu de la liste des exigences réglementaires
Le processus collaboratif de sélection
Un benchmark initial portant sur une vingtaine d’éditeurs, puis, de manière plus détaillée, sur cinq éditeurs, a été présenté au département des systèmes d’information de l’Inserm qui opère le système d’information de France Cohortes.
Cette démarche collaborative, impliquant l’Inserm et les cohortes, a conduit au choix de CleanWeb, une solution robuste et adaptée aux études cliniques complexes.
CleanWeb se distingue par sa flexibilité et sa capacité à répondre aux besoins des cohortes cliniques, bien qu’elle nécessite une formation approfondie pour une prise en main optimale.
Les perspectives et les prochaines étapes
La mise en œuvre de CleanWeb se poursuit avec une phase pilote prévue d’ici début 2025 avec les cohortes RaDiCo. Des formations sont d’ores et déjà planifiées pour préparer les équipes à utiliser cet outil le plus rapidement possible.
Une phase importante d’intégration sera la mise en œuvre du flux sécurisé de bout en bout depuis les outils dédiés à la collecte vers l’environnement de traitement, de data management, et d’analyse statistique de France Cohortes, avec un respect strict de la séparation des données de contact et des données cliniques.
À l’avenir, France Cohortes envisage d’ajouter d’autres outils complémentaires pour répondre aux besoins des chercheurs. Cette démarche s’inscrit dans une volonté d’urbanisation et de mutualisation du système d’information, tout en préservant la flexibilité nécessaire à des projets de recherche diversifiés.
Pour consulter la liste d’exigences réglementaires appliquées à la mise en place d’un outil de collecte pour une cohorte clinique (valable en avril 2024), cliquez ici :